Bentuk molekul
menggambarkan posisi atom yang terikat dalam satu molekul secara tiga dimensi.
Bentuk molekul juga bisa memperlihatkan sudut ikatan, orbital-orbital yang
bersatu dalam membentuk ikatan, dan orbital pasangan elektron bebas yang tidak
membentuk ikatan. Bentuk molekul dapat ditentukan melalui :
1. Teori
tolakan pasangan elektron kulit valensi (VSEPR)
● NOTASI VSEPR
● DAFTAR BENTUK MOLEKUL
PCl3
Atom Pusat 15P : 2,
8, 5 → EV : 5
Atom Pinggir 17Cl : 2, 8, 7→ sb 1
→ total Sb 3 Cl = 3 x 1 = 3
Atom Pusat 6C : 2, 4 → EV : 4
Atom Pinggir 9F : 2, 7 → sb 1
→ total Sb 2 F
= 2 x 1 = 2
Atom Pinggir 8O : 2,
6 → sb 2
→ total Sb 1 O
= 1 x 2 = 2
EV atom pusat (C) = 4
SB total atom pinggir ( F dan O) = 2 + 2 = 4
# Maka :
PEI = 3
( jika sebuah atom menyumbang 2e atau lebih, maka PEI tetap dihitung 1, dalam hal
ini sumbangan atom O di hitung 1 PEI )
PEB = (EV-SB) : 2 = (4 - 4) : 2
= 0
# Notasi : AI3
# Bentuk molekul : Segitiga Planar/datar
2. Teori HIBRIDISASI
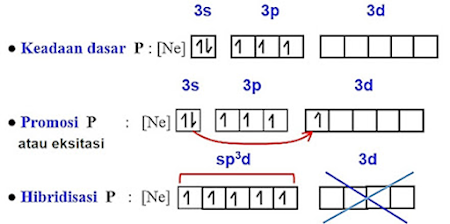
Teori VSEPR dapat memperkirakan bentuk molekul tetapi tidak dapat menjelaskan proses bagaimana molekul-molekul memperoleh bentuknya, demikian juga bagaimana molekul-molekul yang tidak mematuhi (penyimpangan) aturan Oktet memperoleh bentuknya, oleh karenanya dikembangkanlah Teori Hibridisasi yang mampu menjelaskan penyimpangan oktet yang terjadi dengan melibatkan orbital d atom pusatnya (yang hanya dimiliki oleh unsur-unsur perioda 3 ke atas). Adapun pengertian Hibridisasi adalah proses penggabungan orbital-orbital atom (biasanya pada atom pusat) untuk mendapatkan orbital hibrida.Teori hibridisasi hanya dapat menentukan bentuk geometri (bentuk dasar) molekul. Sementara untuk menentukan bentuk molekul, digunakan teori VSEPR.
Jawab : 15 P = (Ne) 3s2 3p3
Elektron pada Posfor (atom pusat) dalam keadaan dasar (kulit terakhir 3s,3p) memungkinkan untuk berkembang ke subkulit 3d :
















 div>
div>






Tidak ada komentar:
Posting Komentar