A. Tujuan :
Menentukan perubahan entalpi reaksi larutan NaOH dengan larutan HCl
dengan kalorimeter (Gelas stereofoam)
B. Teori:
Setiap zat mengandung energi. Entalpi
adalah energi yang terkandung di dalam zat. Perubahan seluruh energy
zat di dalam reaksi disebut dengan perubahan entalpi reaksi. Panas reaksi
adalah energi yang dilepaskan atau diserap bila jumlah mol masing –masing
zat sama dengan koefisien reaksinya. Berikut adalah reaksi netralisasi asam dan
basa :
NaOH(aq) + HCl (aq)
–> NaCl(aq) + H2O(l)
q = - (m x c x ∆T)
∆ H = q/mol
M = massa (gram)
c = kalor jenis air (4,2 J/g.oC)
∆T = perubahan suhu (oC)
C. Alat dan Bahan
No
|
ALAT & BAHAN
|
UKURAN
|
JUMLAH
|
1
|
Gelas stereofoam
|
200 ml
|
1
|
2
|
Gelas ukur
& gelas kimia |
50 ml
|
2
|
3
|
Termometer
|
0 - 50°C
|
1
|
4
|
Larutan NaOH
|
1 M
|
50 ml
|
5
|
Larutan HCl
|
1 M
|
50 ml
|
D. Cara Kerja
1. Masukkan 50 ml larutan NaOH 1 M ke dalam
gelas kimia , ukur shunya.
2.
Masukkan 50 ml larutan HCl 1 M ke
dalam gelas kimia lain, ukur suhunya
3. Termometer harus dibersihkan dan
dikeringkan sebelum dipindahkan dari satu larutan ke larutan yang lain.
4. Hitung suhu rata-rata kedua larutan
tersebut sebagai suhu awal.
5. Tuangkan larutan HCl dan larutan NaOH ke
dalam gelas stereofoam, tutuplah gelas stereofoam dengan tutup yang telah di
tancapi pengaduk dan termometer (lihat gambar). aduk dan perhatikan suhu yang
ditunjukkan oleh terrmometer itu. Suhu akan naik kemudian menjadi tetap dan
selanjutnya turun. Catatlah suhu yang tetap itu (suhu akhir).
E. Hasil Pengamatan
Suhu Larutan NaOH
|
|
Suhu Larutan HCl
|
|
Suhu awal rata-rata
|
|
Suhu tertinggi akhir
(setelah dicampur)
|
|
Perubahan suhu ( ∆T )
|
F.
Pertanyaan
1. Hitunglah q reaksi ?
1. Hitunglah q reaksi ?
2. Hitunglah jumlah
mol NaOH dalam 50 ml larutan NaOH 1 M dan jumlah mol HCl dalam 50 ml larutan
HCl 1 M
3. Hitung qreaksi pada
pembentukan 1 mol H2O (jika NaOH dan HCl yang bereaksi masing-masing 1 mol)
4. Tulislah persamaan
termokimia untuk reaksi ini (∆Hreaksi =
q reaksi pada pembentukan 1 mol H2O).
5. Carilah data kalor
reaksi netralisasi asam-basa dari literatur, kemudian bandingkan dengan hasil
yang anda peroleh dari kegiatan ini. Jika terdapat penyimpangan yang berarti,
cobalah kemukakan penyebabnya!
6. Tariklah kesimpulan dari kegiatan ini
Catatan :
- Untuk
perhitungan, massa larutan dianggap =
100 gram (massajenis dianggap 1 gr/ml)
- Kalor jenis larutan dianggap = 4,2 j/gk 















 div>
div>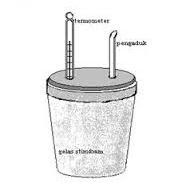

Tidak ada komentar:
Posting Komentar