Sifat-sifat periodik
unsur diantaranya :
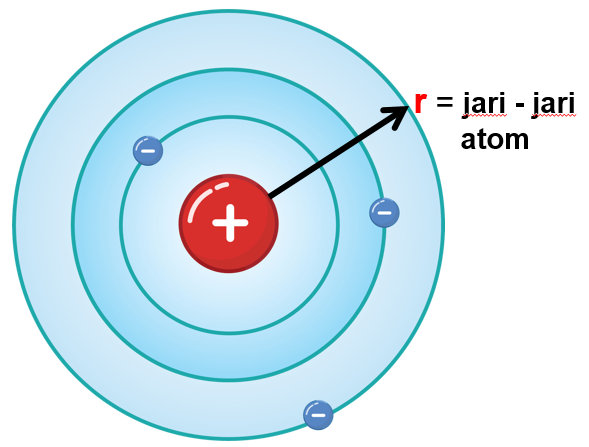
● Jari – jari atom adalah jarak antara inti atom
hingga kulit terluarnya.
● Energi Ionisasi (EI) adalah energi minimal yg
dibutuhkan untuk melepaskan satu elektron pada atom netral dalam wujud gas. contoh :
Ca mempunyai energi
ionisasi pertama, (EI 1) = 590 kJ / mol : artinya untuk melepaskan 1 mol elektron (gas) pada kulit terluar dibutuhkan energi sebesar 590 kj
Ca (g) + 590 kJ → Ca +(g) + e –
Sementara itu,
energi ionisasi kedua (EI 2) adalah jumlah energi yang dibutuhkan untuk
melepaskan elektron kedua dari yang terluar.
Ca+ (g) + 1145 kJ →
Ca 2+ (g) + e –
EI 2 selalu lebih besar dari EI1 karena lebih sulit untuk melepaskan elektron dari ion bermuatan positif. jadi : EI1 < EI2 < EI3
● Afinitas
Elektron adalah energi yang dilepaskan sebuah atom untuk menarik sebuah
elektron. Contoh :
Cl (g) + 1e - → Cl -(g)
( – 349 kJ )
Ketika 1 mol atom
klorin menangkap 1 mol elektron membentuk 1 mol ion klorin, akan dilepaskan energi sebesar 349 kJ.
Jadi, harga afinitas elektron untuk klorin adalah sebesar – 349 kJ/mol. Sementara itu, unsur yang mempunyai afinitas elektron bertanda negatif mempunyai kecenderungan lebih besar menangkap elektron daripada unsur yang afinitas elektronnya bertanda positif. Yang mana, semakin negatif nilai afinitas elektron, berarti makin besar kecenderungan menangkap elektron.
● Keelektronegatifan adalah kemampuan suatu atom untuk menarik elektron ke dalam ikatannya ketika
atom-atom tersebut membentuk ikatan.
Keelektronegatifan diukur dengan menggunakan skala Pauling yang besarnya antara 0,7 sampai 4. Unsur yang mempunyai harga keelektronegatifan besar,
cenderung menerima elektron, membentuk ion negatif. Sedangkan, unsur yang
mempunyai harga keelektronegatifan kecil, cenderung melepaskan elektron, membentuk
ion positif.
LATIHAN SOAL :
1. Pada umumnya energi
ionisasi tingkat pertama (EI 1) lebih kecil dari pada energi ionisasi tingkat kedua (EI 2),
ketiga (EI 3) dan seterusnya. Jelaskan mengapa demikian ?
2. Diketahui
beberapa unsur berikut ini : 32Ge,
33As, 34Se, 35Br, 36Kr
. Manakah unsur yang memiliki jari-jari atom paling kecil ?
3. Jika jari-jari
atom unsur 3Li, 4Be, 5B, 11Na,
dan 19K secara acak (tidak
berurutan) dalam satuan Angstrom adalah : 2,01, 1,57, 1,23, 0,80 dan 0,89, tentukanlah
jari-jari atom Li ?
4. Energi
ionisasi golongan gas mulia secara acak adalah : 10Ne 18Ar, 36Kr, 54Xe, 86 Rn adalah
2080 kJ/mol, 1520 kJ/mol, 1170 kJ/mol, 1350 kJ/mol dan 2372 kJ/mol. Berdasarkan
data tersebut, tentukan harga energi ionisasi unsur Kr ?
5. Unsur P, Q, R
dan S terletak pada satu golongan. Nomor atom unsur tersebut secara berturut
turut adalah 3, 11, 19 dan 37. Berdasarkan nomor atom tersebut, Jelaskan hubungan
antara nomor atom dengan energi ionisasinya ? Buatlah grafiknya !
6. Tentukan
periode dan golongan dari 19K; 15L; 9M, 32 N, kemudian urutkan
atom-atom tersebut menurut : kenaikan jari-jari
atomnya; kenaikan potensial ionisasinya; kenaikan afinitas
elektronnya dan kenaikan keelektronegatifannya !
7. Diketahui
nomor atom sebagai berikut : 20 A; 13 B; 31 C, 7 D, 9 E. Tentukan :
a. Urutan
jari-jari atom terkecil hingga terbesar
b. Urutan
Energi ionnisasi terkecil hingga terbesar
c. Urutan
Afinitas elektron terkecil hingga terbesar
d. Urutan
Keelektronegatifan terkecil hingga terbesar
e. Urutan
Kelogaman terkecil hingga terbesar
8. Unsur A, B, dan C merupakan unsur-unsur yang
terdapat dalam satu golongan. Jika energi ionisasi unsur-unsur tersebut
berturut-turut 419, 403, dan 496. Tentukan urutan unsur tersebut dari atas ke
bawah ?
9. Unsur P, Q, R, S dan T adalah unsur-unsur yang
terletak dalam satu golongan. Q adalah unsur dengan nomor atom tertinggi dan T
adalah unsur yang paling elektronegatif. Jari-jari S lebih kecil dari jari-jari
P. Sedangkan energi ionisasi R lebih besar dari P dan S. Tentukan urutan
unsur-unsur tersebut dalam satu golongan ?
10. Unsur X, Y dan Z terletak dalam satu perioda.
Sedangkan X, M dan N terletak pada golongan yang sama. Unsur dengan jari-jari
terkecil adalah Y dan yang terbesar adalah N. Keelektronegatifan M lebih kecil
dari X. Sedangkan afinitas Z lebih besar daripada X. Tentukan urutan unsur dalam satu perioda dan
golongan ?
11. Unsur A, B, C, dan D adalah unsur-unsur yang
terletak dalam satu perioda. Diantara unsur-unsur tersebut, B memiliki afinitas
elektron terkecil dan C adalah yang terbesar. Jari-jari atom A lebih kecil dari
B dan energi ionisasi D lebih rendah dibandingkan C tetapi lebih tinggi
daripada B. Maka, Tentukan urutan unsur tersebut ?
















 div>
div>
Tidak ada komentar:
Posting Komentar