1) Ubahlah apa yang diketahui dalam soal
menjadi MOL
2) Tulis persamaan reaksi yang digunakan
3) Setarakan persamaan reaksi
4) Tulis perbandingan koefisien reaksi
5) Perbandingkan mol yang sudah dihitung
dengan koefisien reaksi
6) Tentukan mol zat yang dicari (ditanyakan) berdasarkan perbandingan koefisien reaksi
7) Berikut cara menghitung mol zat yang dicari :
8) Ubahlah mol zat yang dicari menjadi sesuai dengan apa yang ditanyakan dalam soal
Fe2O3 +
3CO → 2Fe + 3CO2
Pada reaksi tersebut, ternyata dihasilkan 168 gr besi. Hitunglah
massa besi (III) oksida yang telah bereaksi ? (Ar Fe = 56, C = 12, dan O = 16)
2. Logam
Mg dilarutkan dalam 200 ml larutan asam klorida (HCl) 2,5 M. Menurut reaksi
berikut :
Mg(s) + HCl(aq) → MgCl2(aq) + H2(g)
Hitunglah
:
a.
Massa Mg yang telah dilarutkan ?
b. Volume gas H2
yang dihasilkan pada suhu ruang (RTP) ?
3. Pada suhu dan
tekanan tertentu, direaksikan 10,8 gr aluminium dengan asam klorida. Menurut
persamaan reaksi berikut :
Al + HCl → AlCl3 +
H2 (belum setara)
Jika
pada keadaan tersebut 1 mol gas O2 memiliki volume 5 liter. Hitunglah volume
gas hidrogen yang dihasilkan pada reaksi tsb?(
4. Pada suhu dan tekanan tertentu, berapa liter gas
oksigen yang diperlukan pada pembakaran butana (C4H10) agar
menghasilkan 5,6 liter gas CO2 menurut reaksi berikut :
C4H10 (g) + O2(g) → CO2(g) + H2O(l)
5. Pada suhu dan
temperatur tertentu, pembakaran 2 liter gas CxHy diperlukan 19 liter gas oksigen. Jika pada pembakaran itu terbentuk 12 liter CO2 sesuai
reaksi:
CxHy + O2 → CO2 +
H2O (belum setara)
Tentukan rumus kimia CxHy ?
6. Diketahui
persamaan reaksi:
C(s) + H2 (g) → CH4(g).
Pada keadaan standar, 2,24 L gas H2
direaksikan dengan Carbon, hitunglah jumlah partikel gas CH4 yang
dihasilkan pada keadaan yang sama ?
7. Sebanyak 5
gram logam X direaksikan dengan larutan HCl menurut reaksi:
X + 4 HCl → XCl4 + 2 H2
Gas hidrogen yang terbentuk adalah 6,2 liter diukur pada suhu 25 °C dan tekanan
2 atm Hitunglah Ar X ? (Ar O = 16).
8. Pada penguraian KClO3 menjadi KCl dan gas oksigen, terbentuk 30 liter gas O2 yang diukur pada kondisi di mana 10 liter gas NH3 memiliki massa 1,7 gram. Hitunglah massa KClO3 yang terurai ! (Ar K = 39, Cl = 35,5, O = 16, H=1, N = 14)
9. Sebanyak 43 gram gips (CaSO4.XH2O) dipanaskan hingga air kristalnya menguap dan menghasilkan 34 gram CaSO4 murni. Tentukan rumus hidrat tersebut ?
10. Cuplikan
bubuk besi sebanyak 5 gr dipanaskan dengan gas klorin menghasilkan 10 gr
besi(II)klorida, FeCI2, (Ar Fe = 56, Cl = 35,5). Berapa % kadar
unsur besi dalam cuplikan ?
12. Pada pemanasan 108 gram HgO terbentuk 4,8 gram O2 menurut reaksi:
2HgO(s) → 2Hg(l)
+ O2(g)
Berapa persen HgO yang terurai ? (Ar Hg=200, O=16)
13. Sebanyak X gram
FeS (Mr = 88) direaksikan dengan asam klorida menurut reaksi :
FeS + HCl → FeCl2 +
H2S
Dan diperoleh 8 liter gas H2S.
Jika pada keadaan tersebut 1 mol gas H2S bervolum 20
liter, tentukan nilai X ?
14. jika 0,54 gram
logam Al dimasukkan ke dalam larutan H2SO4 0,1 M,
maka akan terjadi reaksi yang menghasilkan Al2(SO4)3 dan
gas H2. Berapa volume minimal larutan H2SO4 0,1
M yang dibutuhkan agar Al habis bereaksi ? (Ar Al =27, H =1, O = 16,
S =32)
15. Sebanyak
22,5 gram kromium bereaksi dengan larutan tembaga sulfat menghasilkan 19,05
gram tembaga menurut reaksi:
2Cr + 3CuSO4 → Cr2(SO4)3 +
3Cu
Jika massa atom relatif Cu adalah
63,5; berapa massa atom relatif Cr ?
16. Diberikan reaksi logam
aluminium dan larutan asam klorida sebagai berikut :
Al + HCl → AlCl3 + H2 Jika massa logam aluminium yang bereaksi 8,1 gram tentukan volume gas H2 yang terbentuk pada keadaan standar ? (Ar Al = 27; H = 1; Cl = 35,5)
17. Sebanyak 19,5 gram Logam
seng habis bereaksi dengan larutan asam klorida 2M, menghasilkan zink Klorida
dan gas Hidrogen. (Ar Zn = 65, N=14, O=16)
Tentukan :
a. Persamaan reaksi yang setara
b. Volume larutan HCl yang telah
bereaksi ?
c. Volume gas H2 yang dihasilkan diukur pada suhu 25°C dan tekanan 2 atm ?
18. Proses
pengolahan silikon di Industri dilakukan dengan cara mereduksi silika
dengan karbon dalam tanur listrik dengan persamaan reaksi :
SiO2 +
2 C → Si + 2CO
Diketahu Ar Si = 28; O =16; C = 12. Jika dalam 1
hari industri tersebut dapat mengolah 30 ton silika, maka berapa
massa silikon yang dihasilkan ?
19. Sejumlah
2,24 liter gas CO2 pada STP dialirkan ke dalam larutan jenuh
kalsium hidroksida sehingga terjadi reaksi sempurna yang menghasilkan endapan
CaCO3. Berapa massa endapan CaCO3 yang
terbentuk ?
CO2 + Ca(OH)2 →
CaCO3 + H2O (Ar Ca= 40, C = 12, H = 1,
O = 16)
20. Kadar air kristal dlm hidrat Na2CO3 adl 62,94 %. Tentukan rumus hidrat tersebut ? (Ar Na=23 ;
C=12 ; O =16 ; H =1)
21. Reduksi Besi (III) Oksida dengan gas Carbon Monoksida menghasilkan
besi menurut persamaan reaksi
:
Fe2O3 + 3CO →2Fe + 3CO2
Untuk menghasilkan 11,2 kg besi (Ar Fe=56) Berapa massa Fe2O3 yang dibutuhkan ? (Ar Fe=56, O=16)
mol Al = 8,1/27 = 0,3 mol
mol H2SO4 = 0,3 X 2 = 0,6 mol
2Al + 6HCl → 2AlCl3 + 3H2
4 NH3 + 5 O2 → 4 NO + 6 H2O
Jika dalam wadah di reaksikan 34 gram gas NH3 dan 44,8 Liter gas O2 (STP), berapakah volume gas nitrogen monoksida dan berapa jumlah molekul H2O yang dihasilkan ?
Ca(NO3)2 + 2NH4F → CaF2 + 2N2O + 4H2O
Hitunglah massa masing-masing zat yang dihasilkan ?
Bi2O3(s) + C(s) → Bi(s) + CO(g) (belum setara).
Bila direaksikan 92,8 gram Bi2O3 dan 3,6 gram karbon, tentukan:
a. pereaksi pembatasnya,
b. massa logam Bi yang dihasilkan. (Ar Bi=208, O=16, dan C=12)
27. Campuran gas terdiri atas 22 gram gas propana, C3H8, dan 32 gram oksigen. Jika semua oksigen yang ada digunakan untuk mengoksidasi C3H8 dengan sempurna menjadi CO2, berapa massa CO2 yang akan terjadi ? (H=1; C=12; O=16)
28. Ke dalam
100 mL larutan BaCl2 0,2 M ditambahkan 100 mL larutan AgNO3 0,2
M. Tentukan:
a. pereaksi
pembatas
b. pereaksi sisa
c. massa endapan AgCl
29. Sebanyak 5,4 gram logam
aluminium (Ar Al = 27) direaksikan dengan 24,5 gram H2SO4 (Ar H
= 1, S = 32, dan O = 16). Persamaan reaksinya:
2 Al(s) + 3 H2SO4(aq) → Al2(SO4)3(aq) +
3 H2(g)
Tentukanlah :
a. Volume gas H2 Pada suhu 23 0ºC dan tekanan 2 atm ?
b. Massa Al2(SO4)3 yang
terbentuk ?
30. Larutan timbal (II) nitrat
direaksikan dengan larutan KI sesuai reaksi:
Pb(NO3)2(aq) + 2 KI(aq) → PbI2(s) +
2 KNO3(aq)
Tentukan massa PbI2 (Ar Pb = 207 dan I = 127) yang
terbentuk, jika direaksikan:
a. 50 mL larutan Pb(NO3)2 0,1 M dan
50 mL larutan KI 0,1 M
b. 50 mL larutan Pb(NO3)2 0,1 M dan
100 mL larutan KI 0,1 M
c. 50 mL larutan Pb(NO3)2 0,2 M dan 400 mL larutan KI 0,1 M
31.
Sebanyak 20 gram CaCO3 dilarutkan dalam 1 liter
larutan asam klorida 0,2 M menurut persamaan reaksi: (Ar Ca
= 40, Cl = 35,5, C = 12, dan O = 16)
CaCO3(s) +
2 HCl(aq) → CaCl2(aq) + CO2(g) + H2O(l)
a. Tentukan massa
CaCl2 ?
b. Berapa volume CO2 yang dihasilkan bila diukur pada suhu dan tekanan dimana 2 liter gas NO (Ar N = 14 dan O = 16) massanya 1,2 gram ?
32. Kristal
terusi CuSO4.XH2O sebanyak 249 gram dilarutkan dalam
air hingga volumenya 500 mL. Kemudian 100 mL dari larutan itu ditambah larutan
KI secukupnya, ternyata dihasilkan 25.4 gram endapan Iodin (I2)
menurut reaksi berikut :
2CuSO4 +
4KI → 2CuI + I2 + 2K2SO4
Tentukan X dalam kristal CuSO4.XH2O
? (Mr CuSO4 = 159; I2 = 254)
33. Campuran logam
kalsium (Ar Ca = 40) dan aluminium (Ar Al = 27) dengan massa 10,7 gram habis
bereaksi dengan asam sulfat encer. Reaksi ini menghasilkan 7,84 liter gas Hidrogen
(0ºC, 1 atm). Tentukan massa Ca dan Al ?
34. Sebanyak
7,8 gram campuran logam Mg dan Al dilarutkan dalam asam klorida encer.
volume gas hidrogen yang dihasilkan sebanyak 8,96 liter (STP). tentukan susunan
campuran itu ! ( Ar Mg = 24, Al = 27)
35. Sebanyak
10 gram paduan logam seng dengan tembaga dilarutkan dalan asam sulfat encer,
menghasilkan 3 liter gas hidrogen. Pada suhu dan tekanan yang sama, 1 liter gas
NO massanya 1 gram. Tentukan susunan campuran tersebut ? (Ar Cu = 63,5 ;
Zn = 65)
36. Sebanyak
0,1 gram batu kapur dari daerah pegunungan yang mengandung CaCO3,
dilarutkan dalam 25 mL larutan asam klorida 0,1 M menurut reaksi berikut
:
CaCO3 +
2HCl → CaCl2 + CO2 + H2O
Untuk menetralkan kelebihan asam klorida ternyata diperlukan 6 mL larutan
natrium hidroksida 0,1 M. Hitung kadar CaCO3 yang terdapat
dalam sebongkah batu kapur.(Ar Ca = 40, C = 12, O = 16), O
= 16, H=1, N = 14)
















 div>
div>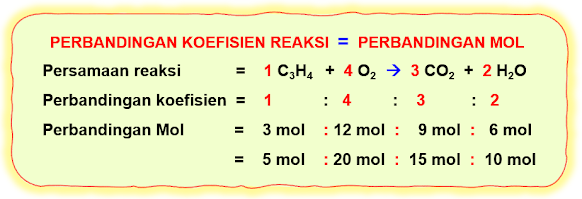



Muaaannntaaabbb, by cici galih
BalasHapusTerimakasih....
BalasHapus