A. MOLARITAS (M)
Jumlah
mol zat terlarut dalam 1 liter larutan
Satuan Molaritas adalah M atau mol/liter
Latihan
soal :
1. Dalam 2 liter larutan HNO3 terdapat 2 mol HNO3, tentukan Molaritas larutan tsb ?
2. Sebanyak 3,7 gram Ca(OH)2 dilarutkan dalam air hingga volume larutan menjadi 400 ml, Hitunglah Molaritas larutan tersebut ? (Mr Ca(OH)2 = 74)
3. Dalam 200 ml larutan H2SO4 terdapat 19,6 gram H2SO4 (Mr = 98), Tentukan Molaritas larutan tersebut ?
B. PENGENCERAN
Menambahkan
pelarut/air untuk mengubah larutan dari konsentrasi tinggi menjadi konsentrasi yang lebih rendah.
Keterangan :
M1 = Molaritas
mula-mula
V1 = Volume
mula-mula
M2 = Molaritas akhir setelah
di encerkan
V2 = Volume akhir
Latihan soal :
1. Ke dalam 300 ml larutan CH3COOH 0,2 M ditambahkan air hingga volume larutan menjadi 500 ml, tentukan Molaritas larutan setelah diencerkan ?
2. Sebanyak 500 ml air ditambahkan ke dalam wadah yang berisi 250 ml larutan HClO4 0,5 M, Hitunglah Molaritas larutan akhir ?
C. PENCAMPURAN
● Mencampurkan sesama asam atau sesama basa yang sama, tetapi konsentrasinya berbeda, contoh mencampur
HCl 2 M dengan HCl 1 M
Mcam = Molaritas campuran
Mx = Molaritas larutan x
Vx = Volume
larutan x
My = Molaritas
larutan y
Vy = Volume
larutan y
Latihan soal :
1. Sebanyak
200 ml larutan HCl 0,3 M dicampurkan dengan 300 ml larutan HCl 0,4 M, Hitunglah
Molaritas larutan setelah dicampurkan ?
2. Berapakah
volume larutan Ba(OH)2 0,2 M yang telah dicampurkan kedalam 400 ml larutan Ba(OH)2 0,1 M sehingga Molaritas campuran menjadi 0,14 M ?
● Mencampurkan sejenis asam atau sejenis basa dengan konsentrasi yang sama/berbeda. Contoh mencampur H2SO4 2 M dengan HNO3 3 M
[H+]cam = Konsentasi
ion H+ campuran
[H+]x = Konsentasi
ion H+ dalam larutan x
Vx = Volume
larutan x
[H+]y = Konsentasi
ion H+ dalam larutan y
Latihan soal :
1. Sebanyak 100 ml larutan H2SO4 0,3 M dicampurkan dengan 300 ml larutan HCl 0,2 M, Hitunglah konsentrasi ion H+ setelah kedua larutan tersebut dicampur ?
2. Hitunglah konsentrasi ion OH- Jika 500 ml larutan NH4OH 0,3 M dicampurkan dengan 200 ml larutan Sr(OH)2 0,1 M ?
D. MENGUBAH PERSEN (%) LARUTAN MENJADI MOLARITAS (M)
Keterangan :
M = Molaritas larutan
% = Persen larutan (contoh: 8 % ditulis 8)
ρ = Massa jenis larutan
Mr = Massa rumus zat terlarut
Latihan soal :
1. Hitunglah Molaritas larutan HBr (Mr = 81) 30 % yang massa jenisnya 1,04 gram/ml ?
2. Diketahui larutan KOH (Mr=56) 1,71 M mempunyai massa jenis 1,2 gram/ml. Tentukanlah persentase larutan KOH tersebut ?
KERJAKAN SOAL - SOAL BERIKUT !
1. Berapa
molaritas larutan, jika 17,4 gram Mg(OH)2 dilarutkan dalam 400
mL air ? (Mr Mg(OH)2 = 58).
2. Suatu larutan dibuat dengan cara mencampurkan 12 gram
etanol (Mr= 46) dengan air untuk mendapatkan volume akhir larutan sebesar 500 ml.
Hitunglah molaritas larutan tersebut ?
3. Tentukan molaritas dari larutan yang terdiri atas 13,68
gram gula pasir (Mr = 342) dalam 0,3 liter larutan ?
4. Diketahui NaOH sebanyak 5 gram dilarutkan dalam air,
sehingga diperoleh 650 ml larutan NaOH (Mr = 40). Berapa kemolaran larutan
tersebut ?
5. Jika ke dalam 250 ml larutan asam sulfat 0,2 M
ditambahkan air hingga volumenya menjadi 400 mL. Hitunglah kemolaran larutan
yang terjadi ?
6. Jika 50 ml HCl 0,3 M diencerkan menjadi 0,1 M. Berapa volume
(ml) air yang harus ditambahkan ke dalam larutan tersebut ?
7. Berapa volume (ml) larutan HBr 0,4 M yang harus
digunakan untuk membuat 400 mL larutan HCI 0,01 M ?
8. Larutan H2SO4 0,2
M sebanyak 80 mL diencerkan sehingga konsentrasinya menjadi 0,01 M. Hitunglah
volume larutan setelah pengenceran dan volume air yang ditambahkan ?
9. Larutan KOH
0,15 M sebanyak 120 mL dicampurkan dengan 130 ml larutan KOH 0,3 M. Tentukanlah
konsentrasi larutan setelah pencamputan ?
10. Berapakah molaritas
ion H+ dalam campuran, jika 100 ml larutan H2SO4 0,25
M dicampur dengan 400 mL HNO3 0,1 M ?
11. Jika ke
dalam 200 ml larutan HClO3 0,2 M, dicampurkan 200 ml larutan HClO3
0,1 M, Berapakah molaritas larutan setelah pencampuran ?
12. Berapa molaritas larutan asam Nitrat 26 % (Mr = 63) dengan
massa jenis 1,12 g/ml ?
13. Berapakah molaritas larutan Ba(OH)2 10
% (Mr = 171) dengan massa jenis 1,178 gram/ml ?
14. Sebanyak 20
ml larutan HNO3 (Mr = 63) dengan kadar 34 % mempunyai massa
jenis 1,04 gram/ml. kemudian ke dalam larutan tersebut ditambahkan air hingga
volumenya 260 ml. tentukan molaritas larutan HNO3 setelah
pengenceran ?
15. Sebanyak 80
ml larutan NaOH 0,45 M dicampur dengan 120 ml larutan NaOH 0,2 M. Kemudian
kedalamnya ditambahkan air 100 ml, berapakah molaritas akhir larutan NaOH ?
16. Berapa gram NaOH (Mr = 40) yang harus ditambahkan ke dalam 200 ml larutan NaOH 0,4 M, agar molaritas larutan berubah menjadi 0,65 M ?
KLIK :
















 div>
div>

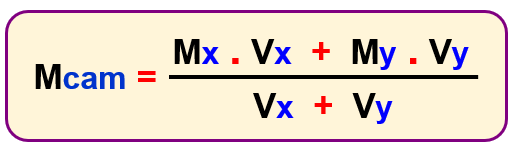


Tidak ada komentar:
Posting Komentar