Contoh :
- atom Mg berikatan dengan atom Cl membentuk MgCl2
- atom C berikatan dengan atom H membentuk CH4
10Ne : 2, 8 (oktet)
18Ar : 2, 8, 8 (oktet)
36Kr : 2, , 18, 8 (oktet)
54Xe : 2, 8, 18, 18, 8 (oktet)
1. Serah terima elektron / transfer elektron (ikatan ion)
2. Saling menyumbangkan elektron untuk dipakai bersama (ikatan kovalen)
Ciri-ciri
ikatan ion :
1. Terjadi antara logam (gol IA, IIA, IIIA) dengan non logam (VA, VIA, VIIA)
2. Logam melepaskan elsktron menjadi ion positif dan non logam menangkap elektron menjadi ion negatif Terjadi antara logam (gol IA, IIA, IIIA) dengan non logam (VA, VIA, VIIA)
Contoh : atom Mg
berikatan ion dengan atom Cl
● 12 Mg : 2,8,2 → melepas 2 elektron
→ 12 Mg+2 : 2,8 (stabil dg elektron terluar 8)
● 17 Cl : 2,8,7 → menangkap 1 elektron
→ 17 Cl -1 : 2,8,8 (stabil dg elektron terluar 8)
( elektron terluar
kurang dari 4 : melepaskan sejumlah elektron hingga EV menjadi 8)
( elektron terluar lebih
dari 4 : menangkap sejumlah elektron hingga EV menjadi 8)
Contoh : atom Al berikatan ion dengan atom
● 13 Al : 2,8,3 → melepas 3 → 13 Al+3 : 2,8 (stabil dg elektron terluar 8)
● 8 O : 2,6 → menangkap 2 → 8 O-2 : 2,8 (stabil dg elektron terluar 8)
Tentukan ikatan ion yang terjadi antara : (gambarkan prosesnya)
1. Na dengan Br
2. Ca dengan S
3. Ba dengan N
4. K dengan N
5. Rb dengan O
6. Al dengan Cl
Ikatan kovalen adalah ikatan yang terjadi antara dua atau lebih atom non logam dengan pemakaian elektron secara bersama. Masing-masing atom yang berikatan menyumbangkan sejumlah elektron untuk dipakai bersama.
Ciri-ciri ikatan kovalen :
1.Terjadi antara sesama non logam yaitu antara golongan IVA,
VA, VIA, VIIA atau sesama golongan itu sendiri.
2.Terjadi antara atom H dengan golongan IVA, VA, VIA, VIIA
● Contoh : atom N berikatan Kovalen dengan atom F
STRUKTUR LEWIS
1. Tentukan elektron valensi
masing-masing atom yang berikatan
2. Tentukan atom pusatnya yaitu
atom yang jumlahnya lebih sedikit atau yang keelektronegatifanya paling kecil.
Atom yang di pinggir disebut atom Luar.
3. Atom pusat dari periode 3 ke
atas dapat dikelilingi oleh elektron lebih dari 8 dan disebut oktet berkembang
atau perkecualian oktet.
4. Tentukan sumbangan elektron
atom luar dan tulislah titik elektronnya terlebih dahulu, kemudian baru atom
pusat menyesuaikan sumbangan atom luar.
● Contoh : atom H berikatan Kovalen dengan atom O
2H + O → H2O
Struktur LEWIS :
Tentukan ikatan kovalen yang terjadi antara : (gambarkan struktur lewisnya)
1. C dengan H
2. N dengan Cl
3. P dengan Br
4. H dengan H
5. O dengan F
6. O dengan O
7. N dengan N
8. C dengan O
No | POLAR | NON POLAR | Ket |
1 | Atom berbeda | Atom sama | Σ atom = 2 |
2 | Ada PEB (Tak ada PEB tapi atom luar berbeda) | Tak ada PEB (Ada PEB tapi bentukmolekul Simetris) | Σ atom > 2 |
3 | Bentuk molekul tidak simetris | Bentuk molekul simetris |
|
4 | Momen dipol > 0 | Momen dipol = 0 |
|
5 | Kelektronegatifan atom berbeda (selisih 0,3 – 1,7) | Keelektronegatifan sama/hampir sama (selisih 0 – 0,3) |
|
6 | Larut dalam air | tidak larut dalam air |
|
IKATAN KOVALEN
KOORDINASI
Ikatan kovalen dimana elektron yang digunakan bersama
hanya berasal dari sumbangan salah satu atom, sedangkan atom lain yang
berikatan tidak menyumbangkan elektron sama sekali. Ikatan kovalen koordinasi bisa terjadi antara ion dengan molekul atau molekul dengan molekul.
Syarat terbentuknya ikatan kovalen koordinasi adalah:
Salah satu atom memiliki
pasangan elektron bebas (PEB) dan Atom yang lainnya memiliki orbital kosong. Berikut contoh ikatan kovalen koordinasi yang terjadi antara molekul NH3 dengan BF3.
1. ion H+ dengan H2O membentuk H3O+
Atom Pinggir 9F : 2, 7 → sb 1 → total Sb = 4 x 1 = 4
elektron yang mengelilingi atom pusat : 4 + 6 = 10 ≠ 8e
Penyimpangan aturan Oktet terdiri dari :
1. Oktet tidak Lengkap
Penyimpangan
ini terjadi pada molekul atom yang kurang 8 elektron. Contohnya terdapat pada
BF3. Atom B dengan 3 elektron valensi dapat berikatan dengan 3 atom F, sehingga
pada akhirnya atom pusat B dikelilingi oleh 6 elektron bukan 8 elektron (oktet)
namun tetap stabil.
2. Oktet Berkembang
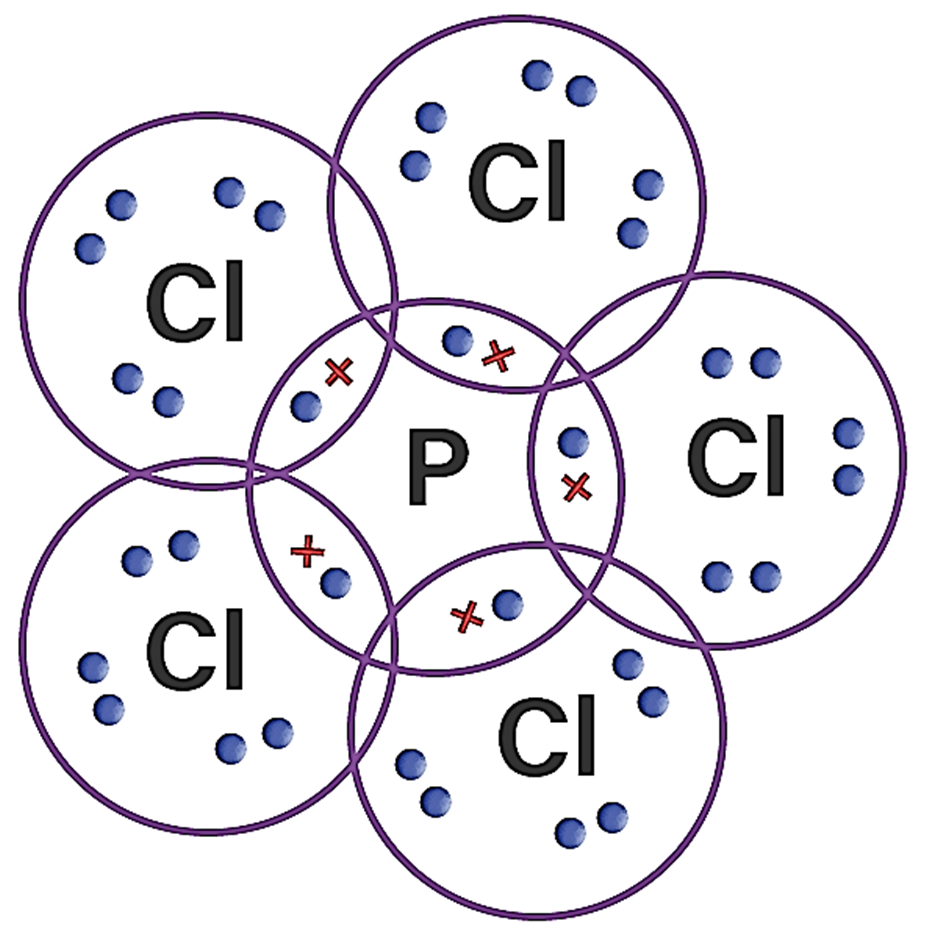
Penyimpangan ini terjadi pada molekul dengan atom pusat dikelilingi lebih 8 elektron. Contohnya terdapat pada PCl5. Atom P mempunyai 5 elektron valensi dapat berikatan dengan 5 atom Cl. Sehingga pada akhirnya atom pusat P dikelilingi oleh 10 elektron bukan 8 elektron (oktet) namun tetap stabil.
|
1. BeCl2 |
6. ClF3 |
11. XeO2 |
16. XeO2F2 |
|
2. ICl5 |
7. BrF4- |
12. XeO3 |
17. XeF5 - |
|
3. SF6 |
8. SbCl5 |
13. XeO4 |
18. XeF5 + |
|
4. BCl3 |
9. XeF2 |
14. XeOF2 |
19. IF4 – |
|
5. SF4 |
10.XeF4 |
15. XeOF4 |
20. ICl4 + |
















 div>
div>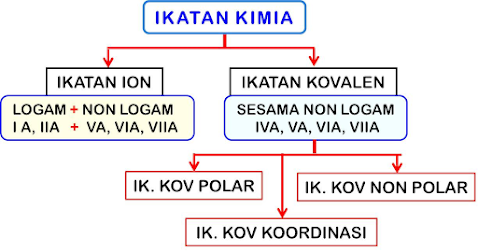








Tidak ada komentar:
Posting Komentar