PENENTUAN ∆H
1. KALOMETRI
Kalorimetri
adalah pengukuran perubahan kalor dengan menggunakan Kalorimeter. Prinsip kerja dari kalorimetri adalah “kalor yang dilepas oleh benda panas (reaksi) sama dengan kalor yang diterima oleh benda dingin” yang
ditandai dengan perubahan suhu (tidak
ada kalor yang keluar atau masuk
dari kalorimeter). Ada dua macam kalorimeter yaitu :
a. Kalorimeter sederhana
Kalorimeter
sederhana digunakan untuk mengukur kalor reaksi dalam bentuk larutan.
Ke dalam suatu kalorimeter sederhana direaksikan 100 mL larutan HBr 0,5 M dan 100 mL larutan NaOH 0,5 M. Setelah reaksi suhu larutan naik sebesar 12°C. Hitunglah perubahan entalpi yang terjadi. (jika dianggap kalorimeter tidak menyerap kalor, massa jenis larutan 1 gr/mL dan kalor jenis larutan 4,2 J/g°C.
Diketahui : mol = M x V
V larutan = V HBr + V NaOH
=100 mL + 100 mL= 200 mL= 200 gram
Ditanyakan: ∆H = ….?
Tulis persamaan thermokimianya ?
Q = m . c . ∆T
Q = 200 . 4,2 . 12
Q = 10080 J = 10,080 Kj
∆H = – Q / mol
∆H = – 10,080 / 0,05 = – 201,6 KJ/mol
Larutan KOH 0,15 M dan larutan HCl 0,15 M yang volume masing-masing 100 mL (suhu awal rata-rata = 15°C) direaksikan dalam kalorimeter. Suhu di dalam kalorimeter naik menjadi 28°C. Hitunglah perubahan entalpi yang terjadi. (jika dianggap kalorimeter tidak menyerap kalor, massa jenis larutan 1 gr/mL dan kalor jenis larutan 4,2 J/g°C.
Kalorimeter bom digunakan untuk mengukur kalor reaksi pembakaran sempurna (dalam O2 berlebih) suatu zat.
Massa Naphthalena = 64 gram → mol = 64/128 = 0,5 mol
Masssa air = 1000 gram
∆T = 7°C
c air = 4,2 J/g°C
C bom = 400 J/°C
JAWAB :
Q = m(air) . c . ∆T + C
. ∆T
Q = 1000 . 4,2 . 7 + 420 . 7
Q = 29400 + 2800 = 32200 J
Q = 32,2 Kj
∆H = - Q / mol
∆H = - 32,2 / 0,5
∆H = - 64,4 Kj/mol
Soal 2 :
















 div>
div>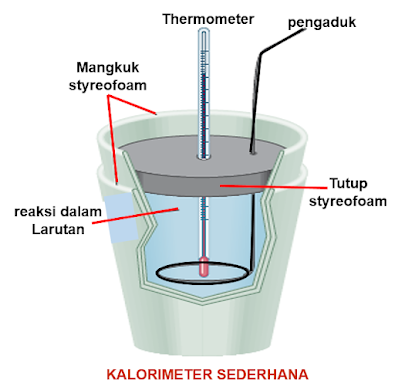




Tidak ada komentar:
Posting Komentar